Pierre Gressens教授概述了microKin项目如何提供了一个更大的框架来理解影响皮质大小的致病机制
小头畸形,即头周缩小超过3个标准差(SD),是一个术语,包含了由于脑容量显著减少而引起的几种常见临床症状。小头畸形可以是综合征的或非综合征的,起源可能是遗传或环境(包括巨细胞病毒、寨卡病毒感染、酒精和照射)。虽然每种特殊类型的小头畸形都很罕见,但小头畸形会影响2%的人口,而且通常与智力迟钝有关。最可能的是,环境和遗传来源的小头症有共同的致病过程,尚待鉴定。1在遗传起源的小头症中,原发性遗传性小头症(MCPH)的特征是大脑体积小(3 -13 SD),与大脑结构的总体异常或其他器官系统的畸形无关,提示在神经元的产生上存在原发性和选择性缺陷。这种缺陷在大脑皮层区域很明显,我们的研究也集中在这个区域。
大脑皮层体积的进化增长
大脑皮层体积的进化增加与心室下带的扩展有关。如图1所示,在早期皮质发生过程中,神经上皮细胞(NECs)是出现的第一类祖细胞。这种最初的祖细胞池通过对称的细胞分裂而扩增。从神经发生开始,神经祖细胞就分布在心室区(VZ)和心室下区(SVZ)两层。VZ由放射状胶质细胞(vRGCs)构成,排列于脑室内,延伸长基底突,横跨整个皮层壁,如图1所示。vRGCs逐渐发生不对称分裂以进行自我更新,首先形成前板的先锋神经元(直接神经发生),然后形成形成SVZ的祖细胞,对应于中间祖细胞(IPC)或基础RGCs (bRGCs)。这些SVZ祖细胞产生皮层神经元(间接神经发生)。如图2所示,vRGC分区结果由分区轴对称的方向决定
尽管这些过程的基本方面在哺乳动物的进化过程中被保存下来,但在大型灵长类动物(包括人类)大脑皮层表面的显著进化扩展中,对祖细胞产生的调整是必要的。皮层的扩张实际上与SVZ的扩展有关,从而形成一个外层,即外SVZ (OSVZ),它包括IPCs和bRGCs。天富注册
bRGCs最初由vRGCs通过不对称分裂产生,然后在OSVZ中分裂,经过自我更新的对称分裂和不对称分裂产生IPCs和神经元。OSVZ祖细胞的这种大规模扩张是哺乳动物进化过程中认知能力逐渐增强的关键解剖学关联。进化控制的OSVZ膨胀的分子机制大部分是未知的
MCPH:一个方便的模型来研究控制大脑皮层生长的机制
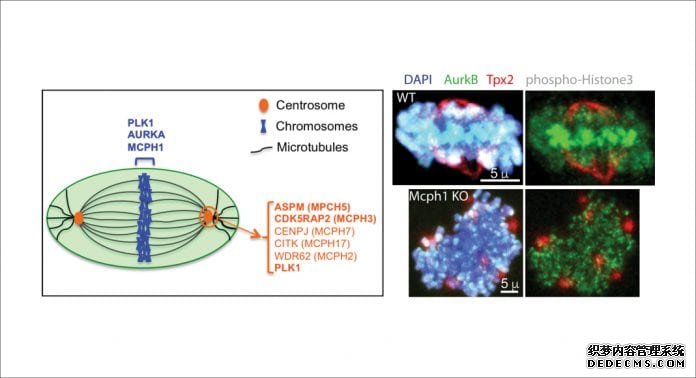
目前鉴定的19个小头畸形基因(MCPH1-19)的初步功能特征表明,大多数MCPH基因编码的蛋白质与中心体及其环境有关,或与染色体浓缩有关,如图5所示。这提示MCPH基因在神经生殖细胞周期调控中起主要作用
在MCPH患者中,可以假设三种非排他机制来解释脑体积的急剧减小和伴随而来的神经元的缺乏:
A细胞周期受损,导致祖细胞增殖能力下降;
自我更新和神经源性分裂之间的不平衡,导致祖细胞数量减少;和
祖细胞和/或有丝分裂后早期神经元过度死亡。
有丝分裂过程的异常可能导致有丝分裂停滞和随后的细胞死亡(通常称为有丝分裂灾难)。MCPH基因突变的小头畸形小鼠模型使我们能够阐明一些潜在的分子缺陷,如中心体装配与细胞周期进程的不协调或微管网络和有丝分裂纺锤体装配之间的不协调
然而,尽管我们在对小头畸形的理解上取得了重大进展,但仍存在重大差距。基于这一知识有限,面临的挑战是扩大我们的知识在这些基因缺陷的路径可能导致异常的细胞分裂和/或祖细胞的大规模死亡,试图将在次优精力充沛或其他情况下,导致缺乏成人。
microKin项目
microKin项目旨在提供一个更大的框架来理解影响皮质大小的病因机制。它受益于四个合作伙伴互补的专业知识:法国Inserm的协调员Pierre Gressens;皮埃尔·范德哈根,比利时布鲁塞尔自由大学;维兰德·赫特纳,马克斯·普朗克细胞生物学和遗传学研究所,德国;Marcos Malumbres,西班牙肿瘤研究中心(CNIO)。因此,本项目依靠多种方法相结合的策略,比较三个MCPH基因——ASPM、CDK5RAP2和MCPH1的功能,并研究这些基因与细胞周期激酶(如PLK1和AURKA)之间的功能相互作用。这些方法包括有条件敲除或诱导标记的MCPH1、CDK5RAP2、ASPM、Aurora A激酶、PLK1在体内或在神经祖细胞中表达;药理学工具(激酶抑制剂);在发育中的小鼠和人类新皮层中进行了详细的表达比较研究;以及基于来自MCPH患者的人iPSCs或使用CRISPR/Cas9策略突变的体外皮质发生模型。
这些工具目前用于探索细胞周期激酶对中心体上加载MCPH蛋白的影响,能量代谢途径对神经祖细胞稳态的影响,以及进一步识别MCPH蛋白和细胞周期激酶的分子伙伴。此外,我们还开发了一些策略,以确定仅在人类或人类和类人猿的OSVZ祖细胞中表达的基因,从而可能参与OSVZ祖细胞的扩增。有趣的是,在显示这种受限模式的基因中,我们从功能上验证了两个基因,ARHGAP11b和NOTCH2NL,它们参与控制OSVZ祖细胞的产生。
值得注意的是,这两个基因来自祖先ARHGAP11a和NOTCH2基因的复制。最后,该联盟有机会分析包括MCPH患者在内的控制组和小头症患者的胎儿人类脑组织,以及MCPH患者的人类iPSCs (hiPSCs),从而使我们能够具体处理:
啮齿类动物和人类祖细胞行为的异同和
与MPCH相关的皮质形态发育缺陷,以及这些缺陷如何也支持其他类型的先天性小头症,从而扩大我们的发现对其他疾病的研究影响。怎么注册天富
总之,本财团的结合和补充专业知识可以解决MCPH通过一个非常原始的发病机理角度,考虑不仅centrosomal缺陷的贡献受损的祖细胞分裂也其他潜在的机制,如有丝分裂灾难,在能量代谢失衡,MCPH蛋白质功能的控制由特定激酶可能治疗相关的疾病。总之,这些研究将提供一个更大的框架来理解MCPH基因和其他关键通路之间复杂的相互作用,以维持完成神经发生所必需的适当的祖细胞池内稳态。
该项目由2015年的ERA-NET II呼吁选择资助。
参考文献
1 Woods, C.G.和Basto, R., 2014, DOI: 10.1016/j.cub.2014.09.063;杜林克斯,S.和Abramowicz, M., 2018, DOI: 10.1016/j.semcdb.2017.09.015
M.佛罗里奥和W.赫特纳B, 2014, DOI: 10.1242/dev.090571
3 Dehay, C. et al. 2015, 10.1016/j.neuron.2014.12.060;Sun, T.和Hevner, R.F., 2014, DOI: 10.1038/nrn3707
4 Duerinckx, S. and Abramowicz, M. 2018, DOI: 10.1016/j.semcdb.2017.09.015
5 Woods, C.G.和Basto, R., 2014, DOI: 10.1016/j.cub.2014.09.063;杜林克斯,S.和Abramowicz, M., 2018, DOI: 10.1016/j.semcdb.2017.09.015
6 Florio, M.等人,2015,DOI: 10.1126/science.aaa1975
7 Florio, M.等人,2018,DOI: 10.7554/eLife。32332;Susuki, I.K.等人,2018,DOI: 10.1016/ j.s. cell.2018.03.067










